Die Standard Reportinglösung für Thermo Scientific™ Watson LIMS™
StudyGen 360 Reporter Bioanalytics
iStudyReporter bzw. der Nachfolger StudyReporter Bioanalytics ist als LIMS Add-On seit über zwanzig Jahren der de-facto Goldstandard für die Erstellung von GxP-konformen bioanalytischen Studien Berichten aus Watson LIMS.
15 der 25 TOP-Pharmaunternehmen und führende CROs setzen Study Reporter bereits erfolgreich für ihre Berichtserstellung ein.
Die Standard Reportinglösung für Watson LIMS™
Unabhängig davon, ob Sie bioanalytische-, klinische- oder Validierungs-Studien, für kleine oder große Moleküle, auf Basis von LCMS, LBA oder Immunogenitätsmessungen benötigen, StudyReporter Bioanalytics bietet die passenden Lösungen.
Erstellen Sie regulatorische, bioanalytische Dokumente in Übereinstimmung mit ICH M10, wie z. B. Validierungs- und klinische Berichte, einfach und schnell auf „Knopfdruck“. StudyReporter automatisiert Reporting Prozesse und eliminiert alle bisherigen Copy&Paste basierten Arbeitsschritte bei der Datenübertragung. Finale Tabellen werden direkt aus dem System erstellt, eine aufwändige manuelle Tabellenformatierung ist nicht mehr erforderlich. Zudem entfällt die komplexe und zeitintensive Datenrevalidierung (Data Cross Check) zur Gewährleistung der Datenintegrität.
Um insbesondere den spezifischen Anforderungen heterogener Labore gerecht zu werden, bietet StudyReporter Bioanalytics ein hohes Maß an Interoperabilität, um maximale Flexibilität bei der Datenerfassung und -verarbeitung aus verschiedenen Systemen (LIMS, ELN, SDMS, MS EXCEL usw.) zu gewährleisten.
Steigern Sie die Effizienz Ihrer Arbeitsabläufe zur Erstellung von Studienberichten. Optimieren Sie Ihre Laborprozesse mit klarem Fokus auf regulatorischen Anforderungen und Compliance, insbesondere im Hinblick auf die erfolgreiche Umsetzung der neuen ICH M10-Richtlinien.
StudyReporter Bioanalytics für Watson LIMS™
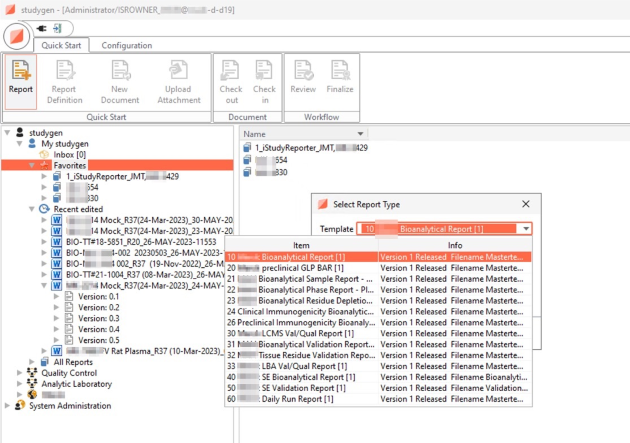
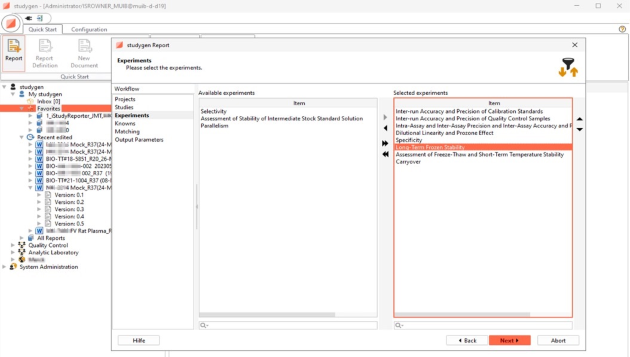

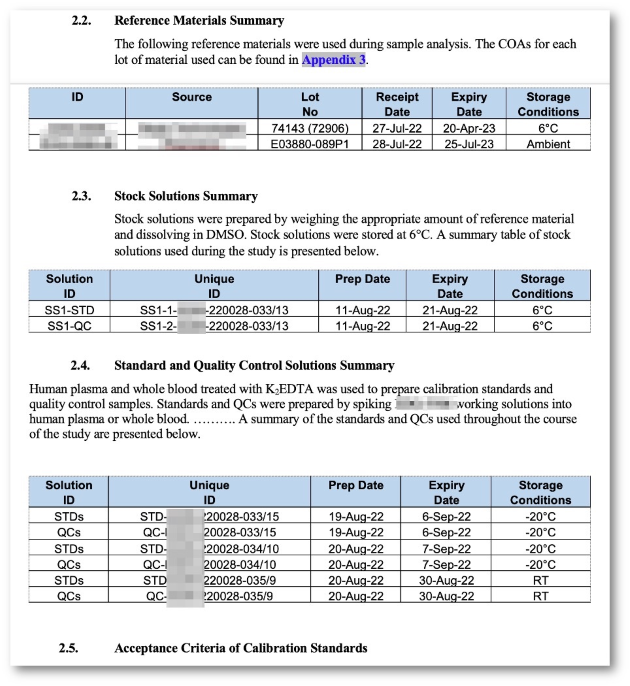
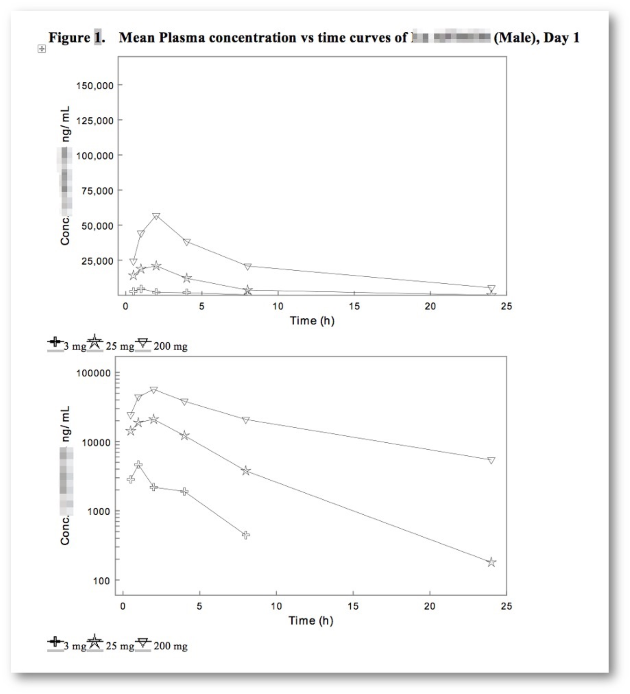
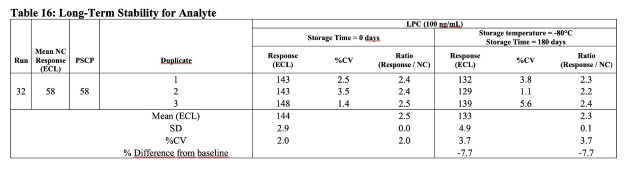
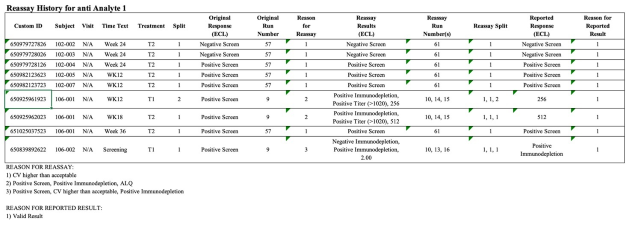
Analytischer Bericht, Tox-Bericht, Validierungsbericht, ADA-Bericht, ADA-Validierungsbericht
Auswahl an Berichten und Tabellen
StudyReporter Bioanalytics Funktionen für Watson LIMS™
Vordefinierte Berichtstemplates
Unterschiedliche off-the-shelf Tabellendarstellungen für die spezifische Datenaufbereitung und Darstellung von Daten aus unterschiedlichen Studientypen
Direkte Interfaces
-
Excel
-
Sciex Analyst© Software
-
Thermo Fisher™ Watson LIMS™
Digitale Berichtsübermittlung (SEND)
Durch eine Exportschnittstelle können auf Basis von erstellten Einreichungsbericht Daten im CDISC „Standard for Exchange of Nonclinical Data“ (SEND) direkt digital übermittelt werden. Gesichert durch eSigs und Prüfpfade für eine vollständige Kontrolle über Ihre Prozesse und Nachweisbarkeit.
Integrierter "Document Life-Cycle" inkl. Versionskontrolle
-
Vollständige Versionskontrolle
-
Alle Änderungen werden nachverfolgt und geprüft
-
Transparente Freigabe von Dokumenten
-
Konfigurierbare Dokumenten-Workflows
-
Detaillierte Zuweisung von Rechten auf Gruppen- und Personenebene
-
Integrierte Benachrichtigungsfunktionen
Unterstützung diverser Output Formate
Compliance, Datenintegrität und Effizienz für Ihre Studie
Ihre Vorteile

100%ige Datenintegrität
Vollautomatisierte Lösung mit direkter LIMS-Integration.

Validiertes Watson LIMS™ Interface
Unterstützung aller Datenbereiche und Studienarten (LCMS, LBA und Immunogenicity).

21 CFR Part 11 Compliance
Vorkonfigurierte Berichte gemäß der Forderungen der ICH M10 und der FDA Guidance (MVA) , inkl. optionales Reporting von „failed Runs“.

Vordefinierte Tabellen und Grafiken
Für alle bioanalytischen Analysearten und Experimente vorkonfiguriert (Toxikologie, klinische Analysen, Validierungsexperimente).

Konfigurierbare Lösung für verschiedenste Templates
LBA/LCMS (Tox-, klinische-, Validierungsvorlage für kleine und große Moleküle), Immunogenität (klinische Validierungsvorlage).

Zeitersparnis & Transparenz
Workflows zur optimierten Unterstützung von CRO-Sponsor Kooperation (DTA und „Sample Reconciliation“).

Ihre Ansprechpartnerin

Head of Sales – Customer Engagement Manager (CEM)
t + 49 6732 9490-57
e sales@uptodata.de