GxP-Berichtsgenerator für Lab Devices
StudyGen 360 Reporter Bioanalytics SaaS
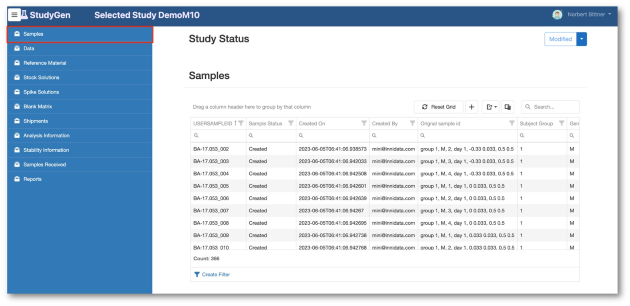
StudyGen 360 bietet einen zentralisierten Ansatz für die Verwaltung von Studiendaten. Alle studienbezogenen Daten, wie z. B. demografische Daten der Probe, Instrumentendaten sowie zusätzliche Studieninformationen werden in einem zentralen cloudbasierten Datenpool gesammelt und gespeichert.
Die Planung der Analysen und Runs, Daten Review sowie Datenanalyse unterliegen der gleichen zentralen Datenquelle, die auf Knopfdruck automatisch generierte GxP-konforme Studienberichte wie auch Non-GxP Informationen liefern kann.
Braucht es ein LIMS wenn alle Daten digital verfügbar sind?
Im Zeitalter der Digitalisierung liegen die meisten Labordaten bereits in einem digitalen Format vor, so dass die effiziente Verwaltung von Labordaten eine entscheidende Rolle in der wissenschaftlichen Forschung und Analyse spielt. Häufig werden für das Datenmanagement LIM-Systeme eingesetzt, die jedoch aufwändig an die bestehenden Laborabläufe angepasst werden müssen. Das bedeuted in erster Linie hohe Investitionen für Lizenzen, Customizing und Hardware, die sich insbesondere kleinere Labore oftmals nicht leisten können.
Durch die Implementierung eines zentralisierten Studiendatenmanagements können digitale Studien- und Gerätedaten einfach in einem sicheren, cloudbasierten Datenpool gesammelt werden, so dass sie für zukünftige Datenanalysen und Berichterstattungsoptionen zur Verfügung stehen, sei es zu Zulassungszwecken oder für jede Art von Analysen, beispielsweise in einer Sponsor-CRO Beziehung. Ein LIMS ist daher nicht mehr zwingend erforderlich.
Steigern Sie die Effizienz Ihrer Arbeitsabläufe zur Erstellung von Studienberichten für die Zulassung, durch die Optimierung Ihrer Laborprozesse. StudyReporter Bioanalytics SaaS ermöglicht Ihnen eine effektive Nutzung aller Laborressourcen bei gleichzeitiger Einhaltung aller regulatorischen Anforderungen, im Hinblick auf die Umsetzungen der neue ICH M10-Richtlinie der richtige Schritt in Richtung Zukunftsfähigkeit Ihres Labors.
StudyReporter Bioanalytics SaaS
Optimierung Ihres Studien Reporting Workflows
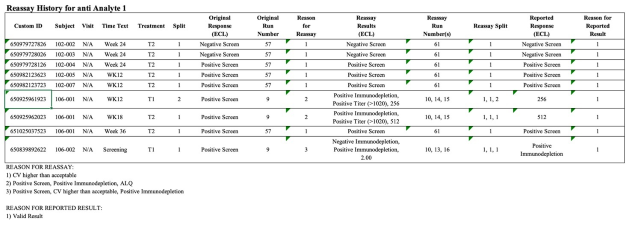
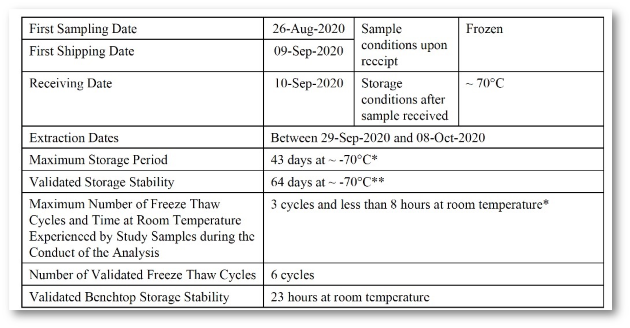
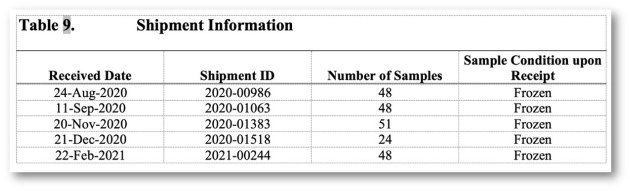
Analytischer Bericht, Tox-Bericht, Validierungsbericht, ADA-Bericht, ADA-Validierungsbericht
Auswahl an Berichten und Tabellen
TOP Study Reporter Bioanalytics SaaS Funktionen
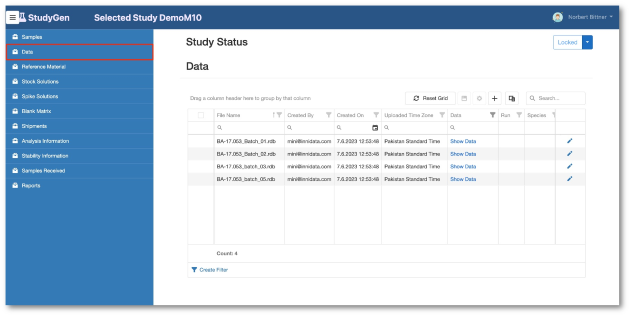
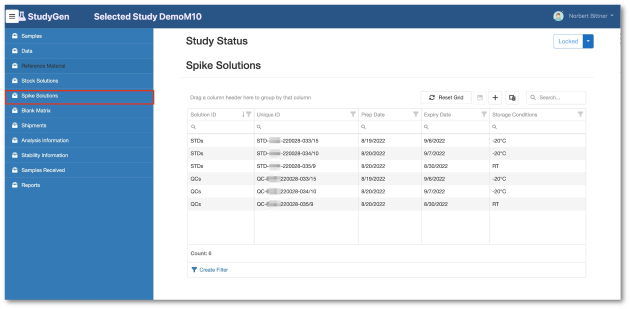
Daten Management
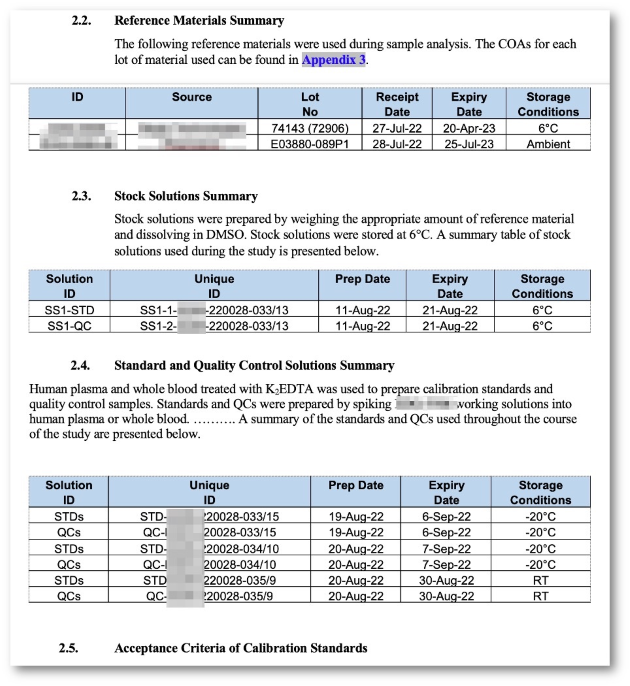
- Vollständige Studiendokumentation inkl. Sample demographics.
- Datenimport aus Sciex Analyst (RDB, WIFF, XML), SoftMax Pro, Excel oder kundenspezifischem LIMS.
- Flexible Assay Konfiguration.
Daten Review
Transparenter Zugang zu Rohdaten.
Reporting
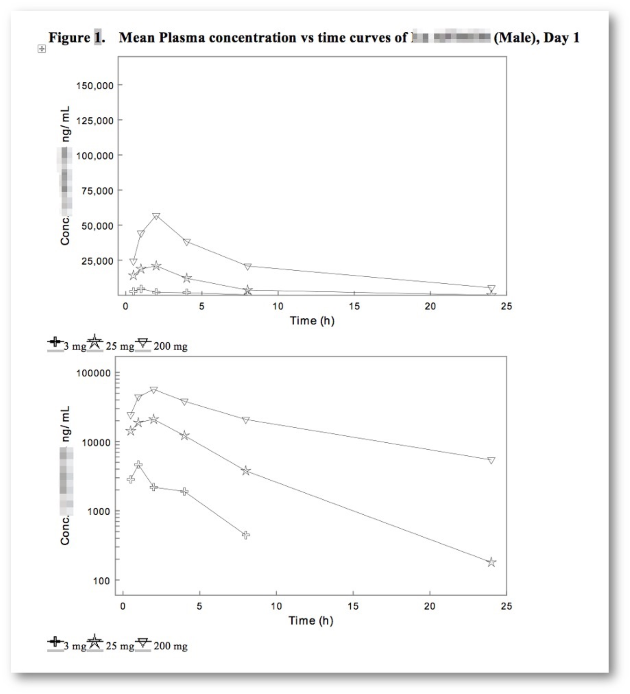
- Graphischer Report Builder (Excel-like maths & statistics).
- Erstellung auf Basis von Word-Dokumenten.
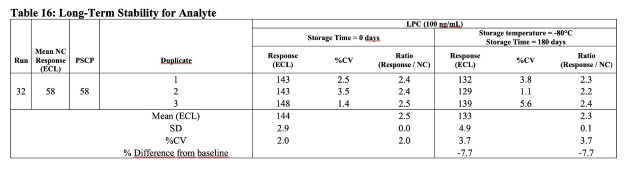
- Verfügbare Tabellenvorlagen: Tox-, Klinische und Validierungsvorlagen für kleine und große Moleküle, Immunogenitäts-, Klinische- und Validierungsvorlagen.
Digitale Berichtsübermittlung (SEND)
Über eine Exportschnittstelle können Daten direkt im CDISC „Standard for Exchange of Nonclinical Data“ (SEND) digital übermittelt werden, basierend auf erstellten Zulassungsberichten – gesichert durch eSignaturen und Audit Trails für eine vollständige Kontrolle über Ihre Prozesse und deren Rückverfolgbarkeit.
Unterstützung verschiedener Output Formate
- Word/Excel/PDF.
Effizienz, Datenintegrität und Compliance
Ihre Vorteile

Automation
Automatisierte Lösung mit voller Datenintegrität unabhängig von spezifischer Instrument- und/oder LIMS-Software.

Flexibilität
Datenimport aus verschiedenen Datenquellen (Analyst, SoftMax Pro, …, Excel, PDF, CSV, Oracle DB, SQL Server, …).

Compliance
Umsetzung aller Anforderungen der 21 CFR Part 11, vorkonfigurierte Berichte gemäß der Forderungen der ICH M10 und der FDA Guidance (MVA) von 2018, inkl. optionales Reporting von fehlgeschlagenen Läufen.

Vorkonfigurierte Tabellen und Grafiken
Für alle bioanalytischen Analysearten und Experimente (Toxikologie, klinische Analysen, Validierungsexperimente).

Erweiterte Template Bearbeitung
Integrierter Layout-Editor für unterschiedliche Vorlagen entsprechend spezieller Sponsor-Anforderungen.

Zeitersparnis & Transparenz
Workflows zur optimierten Unterstützung von CRO-Sponsor Zusammenarbeit (DTA und „Sample Reconciliation“).

Ihre Ansprechpartnerin

Head of Sales – Customer Engagement Manager (CEM)
t + 49 6732 9490-57
e sales@uptodata.de